《人工智能医疗器械注册审查指导原则》征求意见公开发布
发布日期: 2021/06/08 浏览次数:
6月4日,国家药监局器审中心发布了关于公开征求《人工智能医疗器械注册审查指导原则(征求意见稿)》意见的通知。
通知显示,《指导原则》适用于人工智能医疗器械(含体外诊断医疗器械)的注册申报,包括第二类、第三类人工智能独立软件和含有人工智能软件组件的医疗器械,也可用作人工智能医疗器械体系核查的参考。意见征求截止至7月16日。“AI+”产业赋能,药监局全力护航
对于“征求意见稿”的发布,有业内人士表示:“期盼已久”!5G以及AI等技术的迭代更新,“AI+”让医疗器械产业迈入智慧医疗时代,赋予产业发展更多新的契机。
人工智能和医用软件作为医疗器械前沿领域的研究,近年来收到国家药监局的重视。
2020年,随着首张“AI影像辅助诊断软件”、“眼科AI辅助诊断软件”等多款AI辅助诊断软件的相继发布,业界掀起了医用软件的讨论浪潮,医用软件也成为众多互联网巨头尝试进入的医疗器械领域。
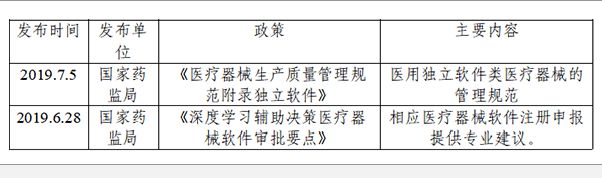
今年3月,国家药监局发布《关于进一步促进医疗器械标准化工作高质量发展的意见》,《意见》中提到“加快推进医用机器人、人工智能、有源植入物、医用软件、5G+工业互联网、多技术融合等医疗器械新兴领域共性技术研究和标准制定工作”。
医用软件相关国家政策
产业发展厚积薄发,CAGR达30.7%
我国医用软件行业市场规模从2014年的212.5亿元增长至2020年的548.5亿元,年复合增长率达14.5%。未来五年,预计中国医用软件行业市场规模将以12.8%的增长率持续增长,并于2023年达到829亿元左右的市场规模。
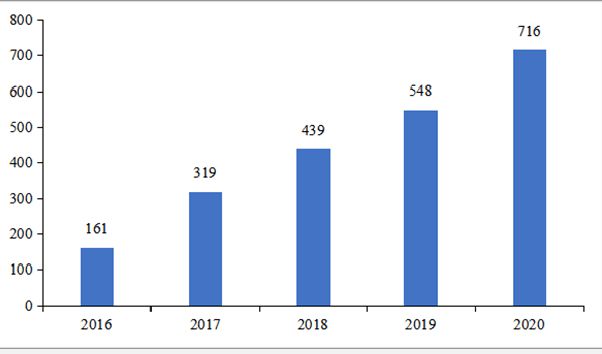
在产品注册上,近年来,全国医用软件注册数量逐年增长。截至2020年底,全国有效的医用软件注册产品总数由2016年的161件到2020年的716件,复合增长率达45.2%,其中,2020年医用软件注册数量相较2019年增长了30.7%。
2016-2020年全国医用软件产品总数
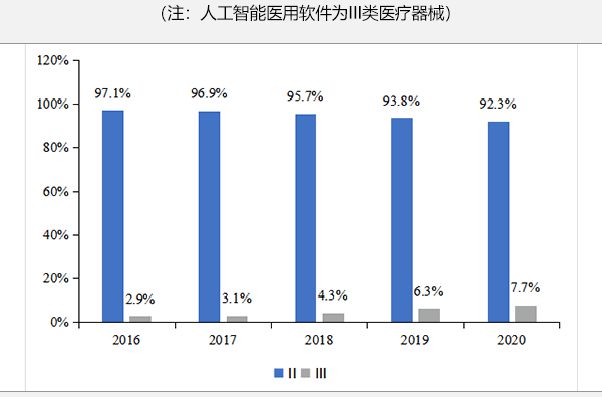
全国已注册的Ⅱ、Ⅲ类软件逐年占比
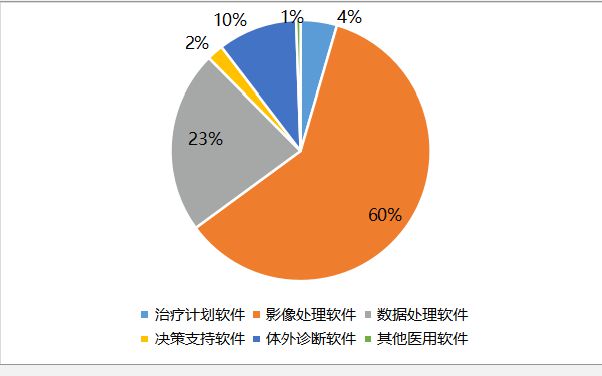
全国医用软件产品品类分布



 国内权威
国内权威 全方位医疗数据
全方位医疗数据 7x24小时
7x24小时 数据安全
数据安全

